题目
举报
二氧化氯(ClO2)是一种高效消毒剂,在60℃时用氯酸钾与草酸(中强酸)反应可制备二氧化氯,实验装置如图所示.已知:通常情况下,二氧化氯的沸点为11.0℃,极易爆炸,制取和使用二氧化氯时要用性质确定的气体稀释,以防爆炸,回答下列问题:
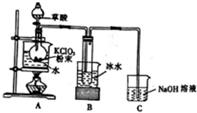
(1)装置A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:___.装置A中还需使用的玻璃仪器是___,其作用是
___.
(2)装置B用冰水浴的原因是___.
(3)实验过程中,装置C的溶液中除了会产生少量Na2CO3外还会生成等物质的量的另外两种钠盐,其中一种为
NaClO2,则另一种钠盐的化学式为___.
(4)已知NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,在温度高于38℃时析出的晶体是NaClO2,请补充从NaClO2溶液中制得NaClO2•3H2O的操作步骤:
a.___;
b.___.
c.过滤、洗涤;
d.干燥.
(5)工业上常用原酸或双氧水还原氯酸钠制备ClO2,用H2O2制备的ClO2比用盐酸制备的ClO2更适合用于饮用水的消毒,其主要原因是___.

(1)装置A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:___.装置A中还需使用的玻璃仪器是___,其作用是
___.
(2)装置B用冰水浴的原因是___.
(3)实验过程中,装置C的溶液中除了会产生少量Na2CO3外还会生成等物质的量的另外两种钠盐,其中一种为
NaClO2,则另一种钠盐的化学式为___.
(4)已知NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,在温度高于38℃时析出的晶体是NaClO2,请补充从NaClO2溶液中制得NaClO2•3H2O的操作步骤:
a.___;
b.___.
c.过滤、洗涤;
d.干燥.
(5)工业上常用原酸或双氧水还原氯酸钠制备ClO2,用H2O2制备的ClO2比用盐酸制备的ClO2更适合用于饮用水的消毒,其主要原因是___.

扫码下载作业帮
搜索答疑一搜即得
答案解析
查看更多优质解析
解答一
举报
实验流程为在60℃时利用氯酸钾与草酸(中强酸)反应制备二氧化氯,并同时生成K2CO3和CO2等,为有效控制温度可使用水浴加热的方式,根据二氧化氯的沸点为11.0℃,易液化,可选择B装置冷却降温收集ClO2,考虑到ClO2极...
实验流程为在60℃时利用氯酸钾与草酸(中强酸)反应制备二氧化氯,并同时生成K2CO3和CO2等,为有效控制温度可使用水浴加热的方式,根据二氧化氯的沸点为11.0℃,易液化,可选择B装置冷却降温收集ClO2,考虑到ClO2极易爆炸,制取和使用二氧化氯时要用性质确定的气体如氮气稀释,以防爆炸,并利用NaOH吸收含ClO2的尾气,防止环境污染,据此分析解题;
(1)装置A中氯酸钾与草酸(中强酸)反应得到二氧化氯,并同时生成K2CO3和CO2等,可根据质量守恒和原子守恒书写方程式;反应需要控制温度为60℃,测定仪器为温度计;
(2)装置B用冰水浴的目的是降温,使ClO2液化,防止气态ClO2爆炸;
(3)用NaOH吸收含有ClO2的尾气,产生之一为NaClO2,可见发生了氧化还原反应,可结合电子守恒和原子守恒判断产物;
(4)根据NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,在温度高于38℃时析出的晶体是NaClO2,故从NaClO2溶液中制得NaClO2•3H2O需要在低温下进行,可选择减压蒸发并低温冷却结晶,最后过滤、洗涤、干燥得到NaClO2•3H2O;
(5)盐酸或双氧水均能还原氯酸钠制备ClO2,但H2O2的氧化产物为O2,而盐酸的氧化产物为氯气,对环境有污染,据此判断选择.
(1)装置A中氯酸钾与草酸(中强酸)反应得到二氧化氯,并同时生成K2CO3和CO2等,可根据质量守恒和原子守恒书写方程式;反应需要控制温度为60℃,测定仪器为温度计;
(2)装置B用冰水浴的目的是降温,使ClO2液化,防止气态ClO2爆炸;
(3)用NaOH吸收含有ClO2的尾气,产生之一为NaClO2,可见发生了氧化还原反应,可结合电子守恒和原子守恒判断产物;
(4)根据NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,在温度高于38℃时析出的晶体是NaClO2,故从NaClO2溶液中制得NaClO2•3H2O需要在低温下进行,可选择减压蒸发并低温冷却结晶,最后过滤、洗涤、干燥得到NaClO2•3H2O;
(5)盐酸或双氧水均能还原氯酸钠制备ClO2,但H2O2的氧化产物为O2,而盐酸的氧化产物为氯气,对环境有污染,据此判断选择.
制备实验方案的设计
本题是物质制备实验探究分析,考查制备原理分析、混合物的分离提纯、实验条件选择等,属基础考查,对提高学生分析问题解决问题的能力有促进作用,难度适中.
解析看不懂?免费查看同类题视频解析

